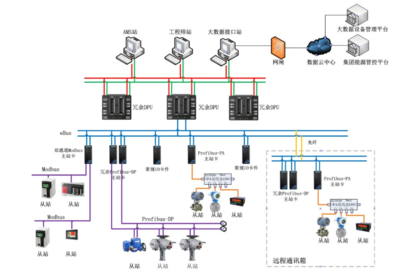
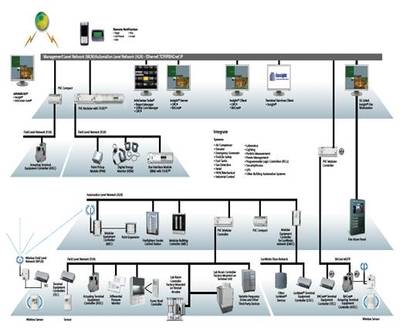
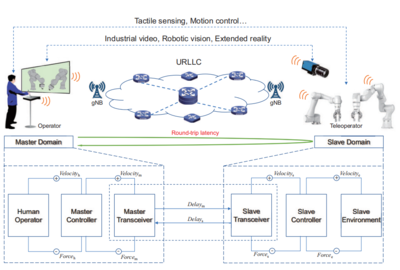
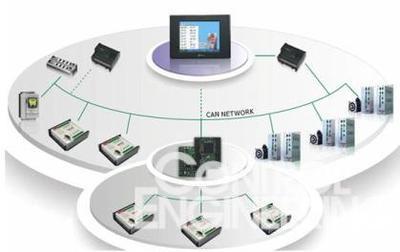
临床研究监查中原始资料的核查与审核流程——以无酒精饮料为例

在临床研究监查过程中,对原始资料的核查与审核是确保研究数据质量与可靠性的关键环节。特别是在涉及无酒精饮料等食品类临床试验中,严格遵循标准操作程序至关重要。
原始资料的核查是指监查员对原始记录(如受试者日记、实验室报告、产品使用记录等)进行检查,以确认数据的准确性、完整性与一致性。以无酒精饮料研究为例,核查内容包括:受试者每日饮用量记录是否清晰、生产批号与试验产品是否匹配、不良事件是否及时上报等。核查过程中需注意原始资料的不可更改性,任何修改必须按规定标注并说明理由。
随后进入审核阶段,这是对核查后数据的系统性评估。审核重点包括:数据是否符合研究方案要求(如无酒精饮料的摄入量是否在设定范围内)、是否存在逻辑矛盾(如受试者声称未饮用试验产品但实验室检测显示代谢物异常)、以及数据收集过程是否遵循GCP(药物临床试验质量管理规范)原则。在无酒精饮料研究中,还需特别关注安慰剂与实际产品的盲法保持情况,以及可能影响结果的外部因素(如受试者同时摄入其他饮料)。
从核查到审核的全流程需建立标准化文件,如监查报告、数据质疑表等,确保每一步可追溯。对于无酒精饮料类研究,还应加强生产与运输记录的审查,防止因产品变质或混淆导致数据偏差。最终通过层层把关,原始资料才能转化为可信的临床试验证据,为产品安全性与有效性提供支撑。
如若转载,请注明出处:http://www.huajian-china.com/product/6.html
更新时间:2026-02-27 11:20:11